OBJECTIVE.
立教大学(東京都豊島区、総長:西原廉太)理学部の岩川弘宙准教授は、植物のRNA誘導サイレンシング複合体(注1)にはDNAに強く結合できるグループが存在することを発見しました。研究成果の内容は、2024年4月16日(火)午前9時5分(日本時間)「Nucleic Acids Research」誌に掲載されました。
発表のポイント
- 植物のRNA誘導サイレンシング複合体(RISC)の3グループが、それぞれ異なる核酸結合特性をもつことを明らかにしました。
- 3グループのうちのひとつである核内で働くRISCは、RNAのみならず、DNAとも強く結合するという、これまで知られていなかった性質をもつことが示唆されました。
- 新たな遺伝子発現制御技術の開発へとつながることが期待されます。
発表概要
今回、立教大学 理学部の岩川弘宙准教授は、植物における3つのグループのRISCが、それぞれ異なる核酸結合特性をもつことを明らかにしました。さらに、細胞質で働く2つのグループは、RNAと強く結合する一方で、核内で働くグループは、RNAと同等、もしくはそれ以上の強さでDNAと結合することを明らかにしました。これらの発見は、「植物のRISCがDNAと直接結合して機能する」という未知の機構の存在を示唆するとともに、新たな遺伝子発現制御ツールの開発につながると期待されます。
本研究の成果は、科学技術振興機構 創発的研究支援事業「植物RNAiの理解と応用:自在な人工ゲノム発現にむけて」(研究代表者:岩川弘宙)、などの支援によって得られたものです。
発表内容
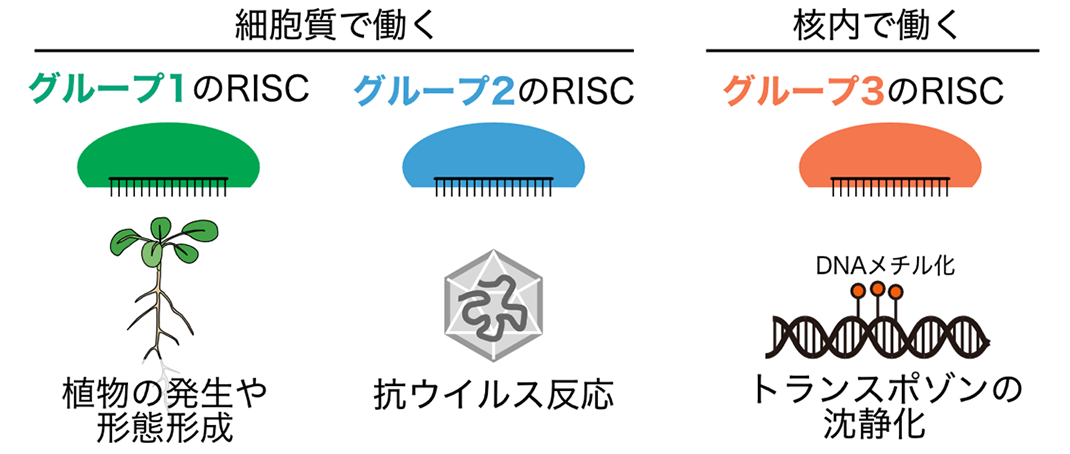
図1.: 各グループに属するRISCの代表的な機能。グループ1のRISC(特にAGO1-RISC)は、植物の発生や形態形成などに重要である。グループ2のAGO2-RISCは、抗ウイルス反応に関わる。グループ3のRISCは、トランスポゾンや非自己遺伝子の沈静化に関わることが知られている。
今回、立教大学理学部の岩川 弘宙准教授は、シロイヌナズナにおける3つのグループに属するRISCの核酸結合特性を解明しました。まず、植物の無細胞翻訳系(注4)を用いて AGOタンパク質を合成し、そこに小分子RNAを加えることで、グループ1に属するAGO1-RISC、グループ2のAGO2-RISC、グループ3のAGO4-RISC、AGO6-RISC、およびAGO9-RISCを形成しました。精製したRISCを、小分子RNAと完全に相補的(塩基対形成をする)、または一部の配列がミスマッチ(塩基対合しない)となる一本鎖のRNAやDNAと混和し、フィルターバインディングアッセイ(注5)と呼ばれる生化学的手法により、結合親和性を定量的に解析しました(図2)。その結果、グループ3のRISCは、グループ1と2のRISCと比べて、3′ 補助領域(注6)の相補性が低い場合でも結合できる(ミスマッチを許容する)性質をもつことが明らかになりました(図3)。さらに興味深いことに、細胞質で働くグループ1と2のRISCはRNAに強く結合するのに対し、核内で働くグループ3のRISCはRNAよりもDNAと強く結合することが明らかになりました(図3)。これらの結果は、各グループのRISCが、固有の機能を発揮するため、異なる標的結合特性を発達させたことを示唆しています。
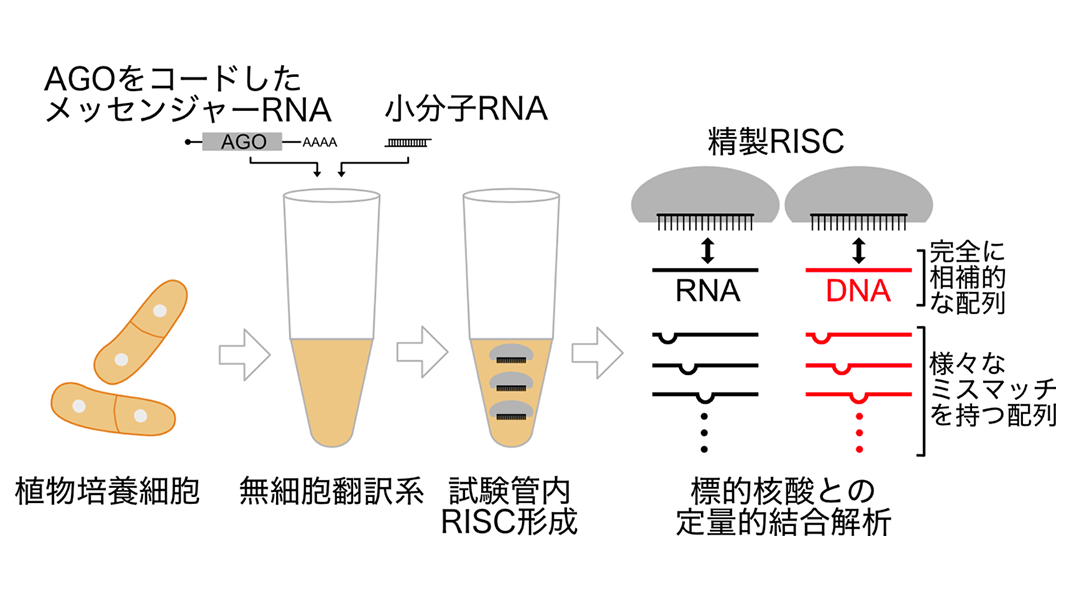
図2: 実験方法。植物培養細胞から作製した無細胞翻訳系でAGOタンパク質を合成し、小分子RNAを加えることでRISCを形成した。次に、小分子RNAと完全に相補的な(塩基対形成する)配列をもつ核酸(DNA/RNA)、または小分子RNAとの間に様々なミスマッチをもつ核酸と精製RISCを混和し、フィルターバインディングアッセイという手法で定量的な結合解析を行った。
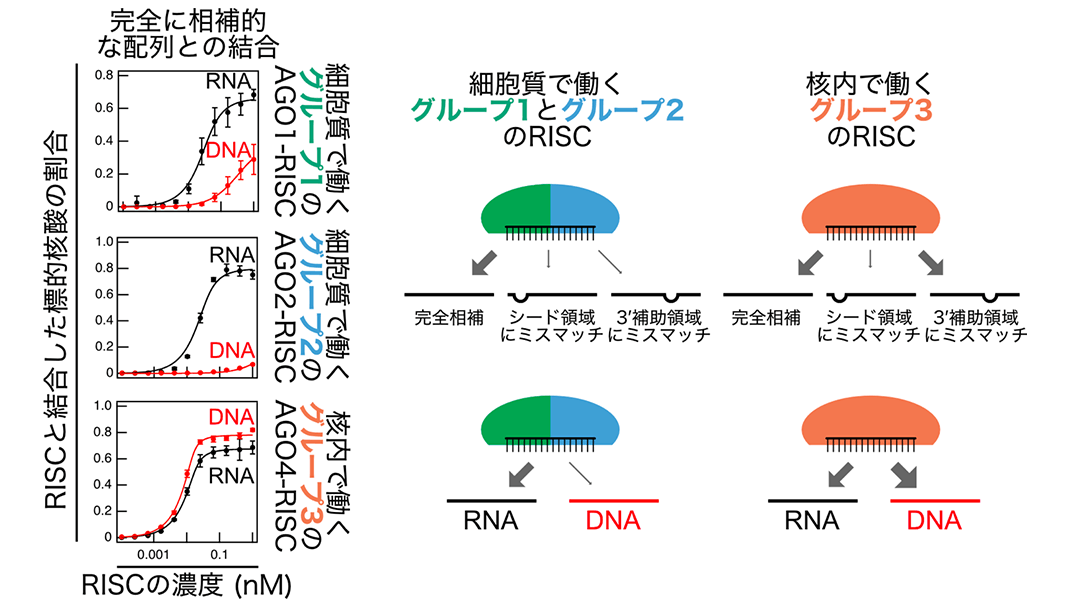
図3: (左)各グループのRISCと標的RNA(黒)および標的DNA(赤)との定量的結合解析の結果の例。(右上)細胞質で働くグループ1とグループ2のRISCに比べて、核内で働くグループ3のRISCは3′補助領域のミスマッチを許容する性質を持つ。(右下)またグループ1とグループ2のRISCはRNAと強く結合するのに対し、グループ3のRISCはDNAにRNAと同等、もしくはそれより強く結合することが明らかになった。
発表雑誌
論文タイトル:The clade-specific target recognition mechanisms of plant RISCs
著者:Hiro-oki Iwakawa
DOI番号:10.1093/nar/gkae257
研究プロジェクト
用語解説
- (注1)RNA誘導サイレンシング複合体(RISC):
1本鎖の小分子RNAとアルゴノート(AGO)と呼ばれるタンパク質からなる複合体。構成成分である小分子RNAと相補的なRNAと結合することで、標的遺伝子の発現を特異的に抑制する働きをもつ。
- (注2)プラスミド:
細菌や酵母の細胞内に存在し、染色体DNAとは異なる、自己増殖するDNA分子の総称。
- (注3)ファージ:
細菌や古細菌に感染し、複製するウイルスの総称。
- (注4)植物の無細胞翻訳系:
植物培養細胞の抽出液にアミノ酸やATPなどを加え、試験管内で翻訳反応を行う実験系。作製したメッセンジャーRNAを加えることで、任意のタンパク質を試験管内で合成することが可能である。細胞抽出液を用いているため、翻訳反応以外の生化学反応も試験管内で再現することができる。本研究では、自作したタバコ無細胞翻訳系を、AGOタンパク質の合成と、RISC形成に用いた。
- (注5)フィルターバインディングアッセイ:
メンブレンフィルターを用いて2つの分子の結合親和性を解析する手法。本研究では、RISCと放射性標識した核酸(RNAまたはDNA)の結合親和性を解析した。
- (注6)3′ 補助領域:
RISC内の小分子RNAは、シード領域(小分子RNAの5′ 末端から数えて2から7または8番目のヌクレオチド)、中央領域(9から12番目までのヌクレオチド)、3′ 補助領域(13から16番目までのヌクレオチド)、テール領域(17番目以降のヌクレオチド)と呼ばれる4つの領域に分けられる。これまでの動物のRISCの研究から、シード領域と標的RNAの塩基対合はRISCと標的との結合に必須であり、3′ 補助領域と標的RNAの塩基対合はRISCと標的との結合を強める働きがあることが知られている。